(1)堿金屬表現哪些共同的化學性質?與原子結構、電子層數、原子半徑的變化有什么
聯系?
(2)堿金屬元素的原子半徑與相應離子半徑的關系?
[小結](1)堿金屬的共同的化學性質與遞變性
a.堿金屬都能與氧氣反應,從鋰到銫反應越來越劇烈,生成物為氧化物(鋰)、過氧化物(鈉)、比過氧化物更復雜的氧化物,如超氧化物等(鉀、銣、銫)。
b.堿金屬都能與水反應,生成氫氧化物和氫氣。從鋰到銫與水反應越來越劇烈。
c.均為強還原劑 M-e-=M+,我們知道,物質的化學性質是由其本性決定的,堿金屬元素的原子結構特點決定了化學性質的相似性和差異性,堿金屬元素原子最外層都是一個電子,決定了它們都是活潑的金屬,強還原性。而隨核電荷數的增加,原子半徑增大,核對外層電子的吸引力逐漸減小,失電子能力逐漸增強,金屬活動性逐漸增強,因而,生成氧化物時越復雜,與水反應更劇烈。
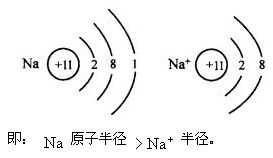
(2)因為堿金屬元素為活潑金屬,易失去最外層電子使次外層變為最外層,所以其原子半徑大于相應的離子半徑。如:
3.焰色反應
[引入]每當我們看到五光十色、絢麗多彩的焰色時就會想:焰火是怎么制造的?為什么燃燒時火焰會有不同的顏色呢?我們下面可以根據演示實驗的現象來解釋這些問題。
[演示]課本第38頁實驗[2—11],學生通過實驗現象得出結論,教師指導學生閱讀課文焰色反應的定義。
[提問]
(1)每次試驗完后,為什么都要用鹽酸洗凈鉑絲(或光潔的鐵絲或鎳、鉻、鎢絲)?
(2)除金屬的化合物之外,單質金屬能不能有同樣的現象?
(3)在觀察鉀的火焰顏色時,為什么要隔著藍色的鈷玻璃?
(4)學習焰色反應的主要作用是什么?讓學生參閱課本封里“焰色反應”彩圖,了解除堿金屬及它們的化合物外,鈣、鍶、鋇、銅等金屬及其化合物也能呈現焰色反應,并重點記憶鈉鉀焰色反應的顏色。強調 指出:由于一般鈉鹽、鉀鹽易溶于水,在溶液中又無顏色,無法通過其他反應進行檢驗“Na+、K+”,所以常常利用焰色反應來檢驗。
總結、擴展
1.總結
堿金屬作為典型的金屬族,通過分析、總結堿金屬元素的性質變化規律,學習最外層電子數相同的一族元素及化合物知識的一般方法;通過對實驗現象的觀察分析,培養了學生透過現象看本質,抓住事物內在的不同和聯系的學習方法。
2.擴展
學習堿金屬元素性質的相同性與遞變性的變化規律,掌握了學習元素及化合物性質的規律的方法,為學習其他各族元素及元素周期律與元素周期表下了一個良好的基礎。
板書設計
第三節 堿金屬
(-)堿金屬元素的原子結構(見下頁)
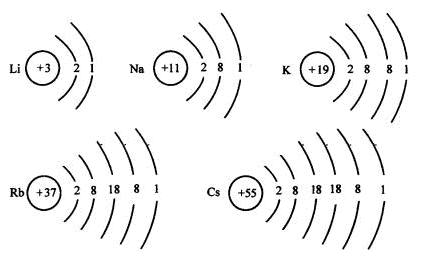
(二)堿金屬單質的物理性質
相同點:硬度小,熔點低,只能放入石蠟或煤油中保存。
不同點:密度依次增大(K反常比Na小),熔沸點依次降低,硬度依次減小。
(三)堿金屬的化學性質
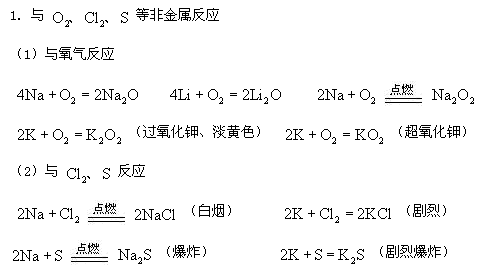

[小結]堿金屬元素的性質與原子結構的變化規律
隨核電荷數的增加,電子層數依次增加,原子半徑依次增大,還原性依次增強。即:
Li<Na<K<Rb<Cs(四)焰色反應
1.定義:(見課本第38頁第三自然段)
2.作用:利用焰色反應,可以測定金屬或金屬離子的存在。
