教學目標
知識目標:
1.能用分子、原子觀點分析化學反應實質;
2.了解原子和分子的相似點、相異點和相互關系。
3.了解原子概念及基本性質;
4.解原子的組成,了解核電荷數、質子數和核外電子數的關系;
5.了解原子的實際質量和相對原子質量的意義,了解相對原子質量的概念以及相對原子質量和原子組成的關系。
能力目標:
培養學生觀察能力,綜合分析能力和抽象思維及邏輯思維能力。
情感目標:
通過實驗和討論激發學生學習興趣,培養學生實事求是作風及探索精神,對學生進行物質不斷運動和無限可分等辨證唯物主義觀點;
認識物質的可分性,逐步培養量變引起質變的辨證唯物主義觀點。
教學建議
教材分析
通過上一節的學習,學生了解了分子的概念及分子的性質,知道"分子是保持物質化學性質的最小粒子"分子是很小的,那么它是否還可以再分呢?
分子是否可分?前一章有關化合反應、分解反應的知識,為這一節的學習做了鋪墊,能順利的引導學生做出正確判斷--分子還可再分。
教材是以氧化汞受熱分解生成汞和氧氣的事實,導出氧化汞分子是由更小的粒子氧原子和汞原子構成的,并繪出了形象的示意圖。將宏觀知識與微觀知識建立起了聯系。通過示意圖的展示,能使學生自然而然的得出原子的概念。為進一步說明原子的真實存在,教材以形象的描述、生動的比喻、引導讀者去想象原子的大小和狀態,并展示了用掃描隧道顯微鏡拍攝的硅原子照片,確鑿證明原子也可以構成物質的事實。
原子是化學變化中的最小粒子,在化學反應中原子不能再分,那么用其它方法或在其它變化中是否能分呢?教材圍繞這個問題討論了原子的組成。
教法建議
人的認識過程是在實踐活動中,從具體到抽象、從感性認識到理性認識。有些理論性知識由于學生缺乏與之相關的感性認識基礎,造成理解上的困難。在講解原子概念時,由于概念抽象學生難懂,建議教學過程中首先演示氧化汞受熱分解的實驗,使學生從宏觀上得到結論:加熱氧化汞能生成汞和氧氣(汞蒸汽有劇毒,實驗可在下圖中進行)在此基礎上,再采用電腦(或磁性黑板)模擬分子、原子圖象展示氧化汞受熱分解的微觀過程,結合學生的分析、討論使抽象的內容變得具體。便于學生理解。通過微觀展示在化學反應中分子的"分"與原子的"合"得出原子的概念,并為今后學習打下基礎。如:對質量守衡定律的學習及化學方程式的學習,對有關化學反應基本類型的學習(置換反應、分解反應等)能加深理解。
分子可以構成物質,原子也可以構成物質。學生已經了解了分子的性質,那么原子有哪些性質那呢?通過展示氧化汞受熱分解的微觀過程,結合閱讀課本、想象由學生總結分子的性質。
至此,學生對分子、原子概念及性質都有了了解,而且原子概念又是通過分解反應得出的。所以有必要讓學生將分子和原子加以對比,了解二者的相似、相異和相關指處。重點應放在兩者的主要區別--在化學反應中能否再分上。對比時可以采取復習、總結、討論的方法。
最后,無論是在課內還是課外,應讓學生閱讀"原子和分子發現"的選學內容,并組織相關的討論:為什么自從用原子-分子論來研究化學以后,化學才有了教快發展?使學生初步意識到,任何科學原理的創立都要付出艱苦的努力,學會用歷史唯物主義的觀點來評價科學家在科學上的貢獻。學習科學家的科學方法和科學態度。
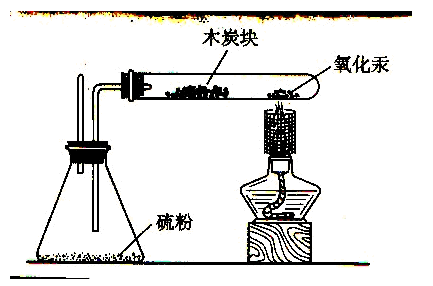
關于原子結構部分,就目前的實驗手段及教學條件來說,還難以讓人們直接看到原子的內部結構,學生缺乏作為分析原子內部結構的感官材料。因此,在教學過程中可以向學生介紹有關科學家研究原子結構的小資料,用以讓學生了解科學家研究原子結構所采用的方法,幫助學生了解原子的構成情況。
教學設計示例 1
教學重點:原子概念的形成及原子和分子的本質區別
教學難點:原子概念的形成、化學反應的實質
教學過程
第一課時
1.復習舊知識 投影:用分子的觀點解釋下列兩個變化
1)液態水受熱變為水蒸氣
2)硫燃燒生成二氧化硫
2.問題引入:物質發生化學變化時有新分子產生,那么分子在化學變化中是如何改變的?又如何由原來的分子轉變成新分子呢?
3.演示實驗:氧化汞受熱分解的實驗
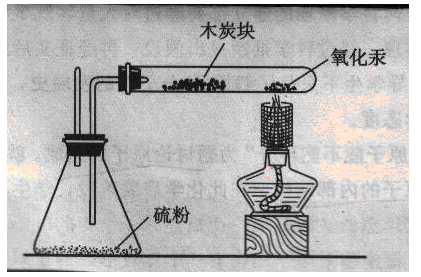
提出觀察要求:
1)先給木炭加熱,觀察木炭有什么變化
2)再同時給氧化汞加熱觀察:
a.試管壁上有什么變化
b.木炭是否燃燒
說明:錐形瓶中的藥品是硫粉,硫粉是用來處理實驗中的有毒物質
學生觀察并描述實驗現象 ( 先給木炭加熱,木炭不能燃燒;同時給氧化汞加熱試管壁上有銀白色小液滴,木炭燃燒。)
4.講述:試管壁上的銀白色小液滴是金屬汞,在常溫下汞是金屬中唯一的一種液體物質
5.思考:木炭為什么能燃燒?指導學生寫出氧化汞受熱反應的文字表達式,(一名學生板演) 判斷反應類型
6.設疑:從宏觀上我們已經得到結論,加熱氧化汞能生成汞和氧氣,那么這個反應在微觀上是怎么變化的呢?(引發學生想弄清氧化汞受熱生成汞和氧氣微觀過程的欲望)
7.多媒體展示:氧化汞受熱分解反應的微觀示意圖 (一)
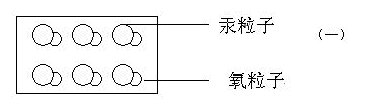
對照畫面講解氧化汞及氧化汞分子的構成 (氧化汞是由氧化汞分子構成的,一個氧化汞分子是由一個氧粒子和一個汞粒子構成的)
8.學生討論:氧化汞受熱從微觀上是怎么變化的?結合多媒體展示的畫面(二)(三)
9.匯報與交流:每組派代表發言。通過小組的分析、講解、補充和糾正得出:氧化汞受熱后結合在一起的氧粒子、汞粒子彼此分開,成為單個的氧粒子和汞粒子。單個的粒子不能穩定存在重新組合,每兩個氧粒子結合在一起構成一個氧分子,大量的氧分子聚集成氧氣,而大量的汞粒子聚集在一起形成金屬汞
10.問題思考:在氧化汞受熱分解反應中,氧化汞分子分解為氧粒子、汞粒子,而氧粒子、汞粒子又分解為更小的粒子了嗎?(沒有)
科學上把這種在化學反應中不能再分的粒子叫原子
思考:通過剛才對氧化汞受熱反應微觀過程的分析,你能說說什么是原子嗎? 回答后總結并板書
板書 第二章 第一節 原子
一、原子
1.概念:原子是化學變化中的最小粒子。
指導學生畫出概念中的重點詞語
為了讓學生進一步確信原子的真實存在,可用實物投影儀展示用掃描隧道顯微鏡拍攝的硅原子照片。
11.問題討論:前面我們學習了分子的概念,現在又學習了原子的概念,請大家結合圖,討論氧化汞受熱是如何發生變化的,變化的實質是什么?結合以下畫面討論
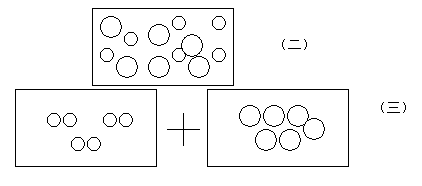
裂變 重新組合
化學反應實質:分子---→原子-------→ 分子 或直接構成 物質(五)
12.匯報與交流:通過交流得出氧化汞受熱反應的變化實質:氧化汞受熱時氧化汞分子先裂變成單個氧原子、汞原子,然后氧原子、汞原子再重新組合,每兩個氧原子結合成一個氧分子,大量的氧分子聚集成氧氣,而大量的汞原子直接構成金屬汞
13.設問:根據以上的分析、討論請同學們說出化學反應的實質是什么?
14:評價 講述:化學反應的實質就是分子裂變成原子,原子重新組合成新的分子或直接構成物質(配合畫面(五)講述,同時板書化學反應實質)
以上多媒體展示的畫面應分步出現
15.設問:我們已經知道分子的基本性質,那么原子有哪些性質呢?
指導閱讀31頁總結出原子的基本性質
16:問題討論:原子和分子是兩種不同的粒子,對照以下表中內容討論它們有哪些相似性,有什么本質區別,相互間有什么關系。
|
|
分子 |
原子 |
|
相似性 |
|
|
|
本質區別 |
|
|
|
相互關系 |
|
|
17.小結:師生共同小結本節知識
[板書設計]
第二章第二節 原子
一.原子
1. 概念:原子是化學變化中的最小粒子
教學設計示例 2
重點和難點:原子的組成和相對原子質量概念的形成
教學過程
一.課前布置復習內容和家庭小實驗
1.復習內容:初二物理摩擦起電原因
2.家庭小實驗:用綢子、毛皮或尼龍布料在塑料棒(或梳子)上摩擦幾下,然后把棒靠近紙屑、頭發、羽毛等輕小物體上,觀察現象。
二.課堂教學過程
1.提出問題引人:"原子是不可再分的粒子"對嗎?
19世紀末以前,原子一直被認為是堅硬的、實心的球,是不可分割的。但是到1897年英國物理學家湯姆生發現電子后,就扣開了原子的大門,使人們逐漸認識到原子也有它本身的結構。
2.思考: 原子中有帶負電的電子,為什么整個原子不顯電性?
3.帶著問題閱讀發放的小資料
小資料:
英國物理學家湯姆生畢業于英國著名的劍橋大學,1896年起從事陰極射線的研究。陰極射線是在真空的玻璃管內,或者說是在含有及稀薄氣體的玻璃管內放電時從陰極放出的射線。1897年,湯姆生在前人研究的基礎上,通過實驗得出結論:陰極射線是帶負電荷的粒子流。1899年湯姆生根據大量實驗得出如下結論:1).原子不是不可分割的,借助于快速運動的原子的碰撞、電力、紫外線和熱等的作用,都能從原子里扯出帶負電的粒子。2).這些粒子具有相同的質量并帶有相同的負電荷,無論它們是從哪種原子里得到的,它們都是一切原子的一個組成部分.3).這些粒子的質量小于一個氫原子質量的千分之一。湯姆生把這些粒子稱為"電子"。電子帶負電,一個電子帶一個單位負電核。
繼湯姆生發現電子以后,盧瑟福通過大量的實驗,1912年春天提出了帶核的原子模型,認為原子是由中心的帶正電的、體積很小的但幾乎集中了原子全部質量的核和在不斷運動著的電子所構成。盧瑟福把這個帶正電的、質量和整個原子差不多但比原子體積小得多的東西叫做原子核。以后科學實驗又證明,原子核是由質子和中子構成的。每個質子帶一個單位的正電荷,中子不帶電。
4.學生討論:通過以上資料你能解釋為什么原子不顯電性嗎?總結原子的構成。
5.匯報與交流:匯報交流討論結果
6.解釋:結合學生的回答進行解釋:原子是由居于原子中心的帶正電的原子核和核外帶負電的電子構成的。由于原子核所帶電量和核外電子的電量相等,但電性相反,所以整個原子不顯電性。
師生共同總結出原子的構成情況
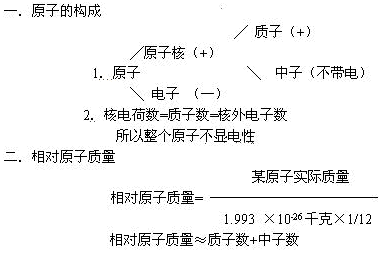
一.原子的構成

(總結過程中可用恰當的比喻描述原子的構成情況:原子核極小,若把原子比成十層大樓,原子核僅相當于一個櫻桃的大小。所以相對來說,原子核外有很大的空間,電子就在這個空間里作高速運動。)
7.學生討論:
投影:課本33頁表2-1幾種原子的構成情況
根據以上幾種原子的構成情況,你能得出哪些結論?四人一組進行討論總結。
8.匯報與交流:匯報交流討論結果。可能的結論有:1)不是所有的原子都含有中子,如氫原子;2)中子數與質子數不一定相等;3)原子核所帶的電荷即核電荷數與質子數相等;4)質子數與核外電子數相等。
板書: 2.核電荷數=質子數=核外電子數
所以整個原子不顯電性
9.設疑:我們已經知道原子很小但有質量,那么原子的質量有多大呢?

10.講解:這樣小的數字書寫、記憶和使用起來都很不方便,就像用噸做單位表示一粒米的質量一樣。因此,在國際上,一般不直接用原子的實際質量,而采用不同原子的相對質量-相對原子質量。
11.指導閱讀:閱讀課本33頁相對原子質量的概念并回答問題:
(1)如何理解相對原子質量概念
(2)怎樣求算某原子的相對原子質量
12.總結:根據學生的回答加以總結:相對原子質量不是原子的實際質量,它是一個比值,單位是一。某原子實際質量是碳原子實際質量1/12的幾倍,這個倍數就是這個原子的相對原子質量
板書

13.講解:課本最后的附錄一就是相對原子質量表,第二章表2-3是常見的相對原子質量的近似植,化學計算采用相對原子質量的近似值。
14.投影:

15.學生討論:根據以上數據你能得出什么結論?
16.匯報與交流:匯報交流討論結果
17.小結:根據學生的回答情況進行小結。
從這一組數據可以看出,質子和中子質量大約相等,且都約等于一種碳原子質量的1/12,而電子的質量很小,相對可以忽略不計,因此原子的質量主要集中在原子核上。相對原子質量近似等于質子數加中子數
相對原子質量≈質子數+中子數
18.總結:指導學生總結本節知識
[板書設計]
探究活動
家庭小實驗:
“摩擦起電”。從宏觀現象探究微觀的本質。
用分子和原子的觀點解釋下列事實:
①水受熱蒸發變成水蒸氣
②磷在空氣中燃燒生成五氧化二磷
